In diesen Kursabschnitt befassen wir uns ausführlich mit dem Thema Korrosion. Dabei behandeln wir im Detail Formen, Ursachen von Korrosion und Schutzmaßnahmen.
Für ein optimales Verständnis helfen dir ausführliche Erklärung und Lernclips + Übungsaufgaben Mehr zu diesem Thema und der Werkstofftechnik findest du im Kurs: WT3-Werkstoffprüfung Oder erst mit den Grundlagen starten? Werkstofftechnik-Basics findest du im Kurs: WT1-Einführung-in-die-Werkstofftechnik
Korrosion – Definition
Der Fachbegriff Korrosion entstammt dem lateinischen “Corrodere” und bedeutet übersetzt “Zernagen”.
Im Maschinenbau stellt Korrosion eine ernsthafte Bedrohung dar, weil sie Werkstoffe schädigt und somit große gesamtwirtschaftliche Kosten erzeugt.
Korrosion ist der allgemeine Begriff für den Abbau von Materialien durch chemische Reaktionen mit ihrer Umgebung. Dieser Prozess tritt oft bei Metallen auf, wenn sie mit Sauerstoff, Wasser oder anderen aggressiven Substanzen in Kontakt kommen. Die häufigste Form der Korrosion ist die sogenannte elektrochemische Korrosion, bei der Metalle durch Oxidation abgebaut werden.

Abgesehen von Metallen, sind auch alle anderen Werkstoffe zu einem gewissen Grad der Korrosion unterworfen. Um uns jedoch ein umfassendes Bild zu verschaffen, beschränken wir uns hier auf Metalle.
Wenn Metalle mit Luft, Wasser, Säuren oder anderen aggressiven Substanzen in Kontakt kommen, können sie oxidieren oder andere Reaktionen eingehen, die zu einem Abbau des Materials führen.
Die häufigste Form der Korrosion bei Metallen ist die sogenannte elektrochemische Korrosion. Dabei spielt eine elektrochemische Zellreaktion eine Rolle, bei der Teile des Metalls oxidiert werden. Eisen, zum Beispiel, kann durch die Reaktion mit Sauerstoff und Wasser zu Eisenoxid (Rost) korrodieren.
Arten der Werkstoffschädigung
Neben der Korrosion wirken auch andere Arten der Werkstoffschädigung. So merkt man bei genauerem Hinsehen gleich, dass gerade Maschinenteile hauptsächlich mechanisch beansprucht werden. Besonders einflussreich sind hier
- Kräfte [Zugkräfte, Druckkräfte]
- Momente [Biegemoment, Torsionsmoment]
- Reibungsvorgänge [Rollreibung, Gleitreibung, etc.]
Allesamt haben den größten Einfluss auf das Werkstoffverhalten von Maschinenteilen und können eine Korrosion unter Umständen sogar noch begünstigen bzw. beschleunigen.
Die Werkstoffschäden, die infolgedessen entstehen können
- Verschleiß: Hier wird die Oberfläche zumeist mechanisch so angegriffen, dass Metallteilchen auf dem Teilchenverbund des Werkstoffes gelöst werden.
- Erosion: In diesem Fall ist die Oberfläche des Werkstoffes der mechanischen Wirkung von Gasen, Flüssigkeiten oder Gemischen ausgesetzt.
- Kavitation: Hier tritt eine Entgasung auf, die wiederum eine Aushöhlung durch Druckabfälle verursacht. An Turbinenschaufeln tritt diese Aushöhlung durch eine Dampfbildung in strömenden Flüssigkeiten auf.
und Weitere sein.
Ursachen der Korrosion
Die Ursachen für Korrosion sind vielfältig und hängen von den spezifischen Bedingungen ab, denen ein Material ausgesetzt ist.

Hier sind einige der häufigsten Ursachen:
-
Luft und Feuchtigkeit: Die Exposition von Metallen gegenüber Luftfeuchtigkeit ist eine häufige Ursache für Korrosion. Insbesondere in feuchten oder salzhaltigen Umgebungen kann der Kontakt mit Wasser oder Feuchtigkeit zu oxidativen Reaktionen führen.
-
Säuren und Basen: Der Kontakt mit sauren oder basischen Substanzen kann Korrosion verursachen. Säuren können Metalle durch den Prozess der chemischen Reaktion mit den Metallatomen angreifen.
-
Salze: Salze, insbesondere in Form von Salzwasser, können die Korrosion beschleunigen. Dies ist ein häufiges Problem in Küstengebieten, wo Metalle durch die salzhaltige Luft und das Wasser stärker gefährdet sind.
-
Elektrochemische Reaktionen: Galvanische Korrosion tritt auf, wenn zwei unterschiedliche Metalle in einem elektrolytischen Medium (wie Wasser) in Kontakt kommen. Dies kann zu einem Abbau des weniger edlen Metalls führen.
-
Mechanische Beanspruchung: Mechanische Spannungen auf einem Material können lokale Korrosionsstellen verursachen, insbesondere wenn das Material in Bewegung ist oder Vibrationen ausgesetzt ist.
-
Temperatur: Extreme Temperaturen können den Korrosionsprozess beschleunigen. Hohe Temperaturen können die Reaktionsgeschwindigkeit erhöhen, während niedrige Temperaturen die Bildung von Eis auf der Metalloberfläche begünstigen können, was zu Korrosion führen kann.
Die genaue Ursache der Korrosion hängt stark von den spezifischen Umweltbedingungen und dem betroffenen Material ab. Der Schutz vor Korrosion erfordert daher oft eine gezielte Herangehensweise, um die spezifischen Einflüsse zu minimieren oder zu verhindern.
Arten der Korrosion
Es gibt verschiedene Arten von Korrosion, darunter:
-
Atmosphärische Korrosion: Verursacht durch die Exposition von Metallen gegenüber Luft und Feuchtigkeit.
-
Galvanische Korrosion: Ein Prozess, der auftritt, wenn zwei unterschiedliche Metalle in einem elektrolytischen Medium (wie Wasser) miteinander in Kontakt kommen.
-
Lochfraßkorrosion: Eine lokalisierte Form der Korrosion, bei der kleine Löcher oder Vertiefungen in der Metalloberfläche entstehen.
-
Spannungsrisskorrosion: Eine Form der Korrosion, die in Verbindung mit mechanischer Spannung auftritt.
Korrosion kann ernsthafte Schäden an metallischen Strukturen verursachen, was zu Materialverlust, strukturellen Schwächen und letztendlich zum Versagen von Bauteilen führen kann. Der Schutz vor Korrosion umfasst die Verwendung von rostbeständigen Materialien, Beschichtungen, Opferschutzsystemen und anderen Methoden, um den Kontakt zwischen dem Metall und korrosiven Substanzen zu minimieren.
Nun folge eine genauere Erläuterung der einzelnen Korrosionsarten:
Atmosphärische Korrosion – Erklärung
Die Atmosphärische Korrosion [oft als chemische Korrosion bezeichnet] ist ein komplexer Prozess, der auftritt, wenn Metalle mit den Bestandteilen der Luft, insbesondere Sauerstoff und Feuchtigkeit, in Kontakt kommen. Dieser Prozess führt zu einer schrittweisen Zersetzung des Metalls über die Zeit. Die häufigste Form der atmosphärischen Korrosion ist die Bildung von Rost auf der Oberfläche von Metallen, vor allem bei Eisen und Stahl.

Hier sind die Hauptphasen dieses Korrosionsprozesses:
-
Bildung von Metalloxiden: Metalle reagieren mit dem Sauerstoff in der Luft und bilden Metalloxide. Bei Eisen entsteht Eisenoxid, das umgangssprachlich als Rost bezeichnet wird. Diese Oxidschicht bildet sich auf der Oberfläche des Metalls und schützt es zunächst vor weiterer Korrosion.
-
Durchdringung der Oxidschicht: Im Laufe der Zeit kann die Oxidschicht durchlässig werden, insbesondere wenn sie mechanischer Belastung, Feuchtigkeit oder aggressiven Umweltbedingungen ausgesetzt ist. Wasser, Salze und andere Verunreinigungen können dazu beitragen, dass die Oxidschicht durchlässig wird.
-
Fortgesetzte Korrosion: Wenn die Oxidschicht durchbrochen ist, setzt die eigentliche Korrosion ein. Sauerstoff und Feuchtigkeit greifen das darunter liegende Metall weiter an, was zu einer Ausdehnung des Korrosionsprozesses führt.
Faktoren, die atmosphärische Korrosion beeinflussen können, sind unter anderem:
-
Luftfeuchtigkeit: Hohe Luftfeuchtigkeit begünstigt die Korrosion, da Wasser ein wichtiger Bestandteil des Korrosionsprozesses ist.
-
Luftverschmutzung: Schadstoffe in der Luft können die Oxidation beschleunigen und die Bildung von aggressiven Substanzen fördern, die die Metalle angreifen.
-
Temperatur: Extreme Temperaturen können die Geschwindigkeit der Korrosion beeinflussen.
-
Salzbelastung: In Küstengebieten, wo Salz in der Luft vorhanden ist, kann die Korrosion besonders stark sein.
Galvanische Korrosion – Erklärung
Die galvanische Korrosion, auch als elektrochemische Korrosion bekannt, ist ein Korrosionsprozess, der auftritt, wenn zwei unterschiedliche metallische Materialien direkt miteinander in Kontakt kommen und dabei eine elektrische Verbindung herstellen. Diese Korrosionsform beruht auf elektrochemischen Zellreaktionen zwischen den Metallen und wird durch ein elektrolytisches Medium wie Wasser begünstigt.

Hier sind die Hauptkomponenten und Phasen der galvanischen Korrosion:
-
Zwei unterschiedliche Metalle: In einem galvanischen Korrosionspaar sind zwei verschiedene metallische Werkstoffe beteiligt. Diese Metalle haben unterschiedliche elektrochemische Eigenschaften und sind in der elektrochemischen Spannungsreihe unterschiedlich positioniert.
-
Elektrolytisches Medium: Ein elektrisch leitfähiges Medium, typischerweise Wasser oder eine feuchte Umgebung, fungiert als Elektrolyt. Dies ermöglicht den Transport von Ionen zwischen den beiden metallischen Werkstoffen.
-
Elektrochemische Reaktionen: Durch den Kontakt der beiden unterschiedlichen Metalle und die Anwesenheit des Elektrolyten entstehen elektrochemische Zellen. Ein Metall (das “opfernde” Metall) gibt Elektronen ab und oxidiert, während das andere Metall (das “edlere” Metall) Elektronen aufnimmt und reduziert wird.
-
Korrosion des opfernden Metalls: Das Metall, das Elektronen abgibt, neigt dazu, zu korrodieren oder zu oxidieren. Es wird als “Opfermetall” bezeichnet, da es den Hauptteil der Korrosion erleidet.
-
Schutz des edleren Metalls: Das edlere Metall wird durch die Elektronenaufnahme geschützt und erfährt weniger oder keine Korrosion. In diesem Zusammenhang wird es als “Schutzmetall” bezeichnet.
Galvanische Korrosion kann in verschiedenen Umgebungen auftreten, insbesondere wenn verschiedene metallische Materialien in direktem Kontakt stehen, beispielsweise in Schiffen, Rohrleitungen oder elektrischen Verbindungen. Um galvanische Korrosion zu minimieren, können Maßnahmen wie die Verwendung von korrosionsbeständigen Materialien, Isolierung der Metalle voneinander und die Verwendung von Opferanoden ergriffen werden.
Lochfraßkorrosion – Erklärung
Die Lochfraßkorrosion ist eine besonders aggressive Form der Korrosion, die durch lokale Angriffe auf die Oberfläche eines Metalls gekennzeichnet ist. Im Gegensatz zu gleichmäßiger Korrosion, die die gesamte Oberfläche betreffen kann, tritt bei der Lochfraßkorrosion der Abbau in Form kleiner, tiefer Löcher oder Gruben auf. Dieser spezielle Korrosionsmechanismus ist oft bei bestimmten Legierungen, insbesondere Aluminiumlegierungen, Edelstählen und anderen hochkorrosionsbeständigen Materialien, zu beobachten.

Hier sind die Hauptmerkmale und Ursachen der Lochfraßkorrosion:
-
Lokale Angriffsbereiche: Lochfraßkorrosion konzentriert sich auf spezifische Stellen auf der Metalloberfläche, oft an Stellen, wo das Metall bereits durch andere Formen der Korrosion geschwächt wurde oder wo sich Verunreinigungen angesammelt haben.
-
Elektrochemische Reaktionen: Ähnlich wie bei anderen Formen der Korrosion beruht auch die Lochfraßkorrosion auf elektrochemischen Reaktionen. Ein bestimmter Bereich auf der Metalloberfläche wird zu einem “anodischen Bereich”, wo Oxidation stattfindet, während andere Bereiche zu “kathodischen Bereichen” werden, wo Reduktion stattfindet.
-
Bildung von Gruben: An den anodischen Bereichen bildet sich eine lokalisierte, oft tiefe Grube oder ein Loch, wodurch das Material weiter geschwächt wird. Diese Gruben können sich tief ins Innere des Materials erstrecken, bevor sie an der Oberfläche sichtbar werden.
-
Verstärkung durch Feuchtigkeit und Salze: Feuchtigkeit und Salze können den Prozess der Lochfraßkorrosion verstärken. Das Vorhandensein von Feuchtigkeit erleichtert die elektrochemischen Reaktionen, während Salze als Elektrolyte wirken und den Transport von Ionen ermöglichen.
Die Lochfraßkorrosion kann in verschiedenen Umgebungen auftreten, einschließlich mariner Umgebungen oder in industriellen Anwendungen, bei denen aggressive Chemikalien im Spiel sind. Schutzmaßnahmen gegen Lochfraßkorrosion umfassen die Verwendung von korrosionsbeständigen Legierungen, Beschichtungen, regelmäßige Inspektionen und Wartung sowie das Minimieren von Feuchtigkeit und Verunreinigungen auf der Metalloberfläche.
Spannungsrisskorrosion – Erklärung
Die Spannungsrisskorrosion ist eine spezielle Form der Korrosion, bei der Materialien unter Zugspannung in einer korrosiven Umgebung versagen. Diese Art der Korrosion kann zu Rissen und letztendlich zum Bruch von Bauteilen führen, selbst wenn die allgemeine Korrosion an der Oberfläche nicht sehr ausgeprägt ist. Dieser Korrosionsmechanismus tritt häufig bei Metallen und Legierungen auf und ist besonders problematisch, da er zu plötzlichem Materialversagen führen kann, ohne dass zunächst deutliche Anzeichen an der Oberfläche sichtbar sind.

Hier sind die Hauptmerkmale und Ursachen der Spannungsrisskorrosion:
-
Zugspannung: Spannungsrisskorrosion tritt auf, wenn ein Material einer anhaltenden Zugspannung ausgesetzt ist. Diese Spannung kann von äußeren Belastungen, wie zum Beispiel mechanischer Beanspruchung oder inneren Spannungen im Material, herrühren.
-
Korrosive Umgebung: Das Vorhandensein einer korrosiven Umgebung ist entscheidend. Das Material muss sowohl Zugspannungen als auch eine korrosive Umgebung erleben, damit Spannungsrisskorrosion auftritt.
-
Korrosive Rissbildung: Die Zugspannung erleichtert die Bildung von Rissen in der Metalloberfläche. Diese Risse können dann von korrosiven Substanzen durchdrungen werden, die in der Umgebung vorhanden sind.
-
Lokale Angriffsbereiche: Anders als bei gleichmäßiger Korrosion konzentriert sich die Spannungsrisskorrosion auf bestimmte lokale Bereiche, wo Risse auftreten.
-
Beschleunigter Risswachstum: Ein charakteristisches Merkmal der Spannungsrisskorrosion ist das beschleunigte Wachstum der Risse unter der Kombination von Spannung und Korrosion.
Diese Form der Korrosion kann in verschiedenen Branchen auftreten, wie beispielsweise in der chemischen Industrie, der Luftfahrt, der Energieerzeugung und anderen Bereichen, in denen Materialien hohen Spannungen und korrosiven Umgebungen ausgesetzt sind. Um Spannungsrisskorrosion zu verhindern, können Maßnahmen wie die Auswahl korrosionsbeständiger Materialien, die Minimierung von inneren Spannungen, das Design von Bauteilen mit geringerer Anfälligkeit für Spannungsrisskorrosion und die Kontrolle der Umgebungseinflüsse ergriffen werden.
Erscheinungsformen der Korrosion – Korrosionsprodukte
Die Korrosion kann auf drei unterschiedliche Arten erfolgen:
- Gleichmäßige Korrosion
- Ungleichmäßige Korrosion
- Korrosion durch mechanische Beanspruchung
Gleichmäßige Korrosion
In dieser Version erfolgt die Abtragung des Metall weitestgehend parallel zur Oberfläche des Materials. Dabei wird der Querschnitt des Bauteils gleichmäßig geschwächt. Diese Form ist die häufigste Erscheinung und wird nicht selten als Flächenkorrosion bezeichnet.
Die Angriffsmedien sind hier Wasser und verunreinigte Luft.


Ungleichmäßige Korrosion
Bei der ungleichmäßigen Form, kommt es zu einer lokalen Abtragung. Hier unterscheiden wir zwischen der
- Spaltkorrosion,
- Kontaktkorrosion,
- selektiver Korrosion,
- Lochfraß sowie
- interkristalline Korrosion und
- transkristalline Korrosion.
Spaltkorrosion – Erklärung
Hier liegt ein Spalt zwischen zwei Bauteilen vor, in welchem es zu einer intensiven lokalen Wirkung kommt. Die Voraussetzung ist hier das Vorhandensein eines Elektrolyt [Wasser, Laugen, Gase]. Infolge der Kapillarwirkung verbleibt die Flüssigkeit im Spalt und setzt den Vorgang fort. Beispiel – Betroffene Bereiche: Gashauben, Faultürme

Kontaktkorrosion – Erklärung
Bei dieser Form, stehen zwei unterschiedliche metallische Werkstoffe in direkt Verbindung mit einander. Dabei wirkt das unedlere Metall als Anode [geht in Lösung] und das edlere Metall als Kathode [nimmt auf]. Man spricht hier auch von einer Bi-Metall-Korrosion. Beispiel – Betroffene Bereiche: Unter Schraubenköpfen, Ketten mit unterschiedlichen Metallen.

Selektive Korrosion – Erklärung
Selektive Korrosion, auch als Lokale Korrosion bekannt, ist ein spezifischer Typ der Korrosion, bei dem nur bestimmte Bereiche eines metallischen Werkstoffs von der Korrosion betroffen sind, während andere Regionen weitgehend verschont bleiben. Dieser selektive Angriff kann zu einer ungleichmäßigen Materialentfernung führen und in Form von Gruben, Löchern oder Rissen auftreten. Es gibt verschiedene Arten der selektiven Korrosion, darunter Lochfraßkorrosion, Spaltkorrosion und Interkristalline sowie transkristalline Korrosion.

Lochfraß – Erklärung
Hier ist besondere Aufmerksamkeit geboten, da hier die Materialabtragung nicht so gut zu erkennen ist. Oberflächlich sieht man meist nur einen kleinen Riss oder eine kleine Pore. Unter der Oberfläche setzt sich der Vorgang dann unvermindert fort. Beispiel – Betroffene Bereiche : Schwimmbäder

Interkristalline Korrosion – Erklärung
Die Auflösung des Metalls findet an den Korngrenzen oder Phasengrenzen statt. Die Ursache liegt in den Konzentrationsunterschieden zwischen Kern und Rand der Kristallite. Im Worst-Case entstehen dadurch Risse im Bauteil verursacht durch einen Kornzerfall. Beispiel – Betroffene Bereiche: Gießfehler, Schweißfehler

Transkristalline Korrosion – Erklärung
Transkristalline Korrosion ist eine spezielle Form der Korrosion, bei der der Korrosionsangriff entlang der Körner oder Kristallstrukturen eines metallischen Werkstoffs stattfindet. Im Gegensatz zur interkristallinen Korrosion, die sich auf die Korrosion entlang der Korngrenzen konzentriert, tritt die transkristalline Korrosion innerhalb der Kristalle selbst auf. Beispiel – Betroffene Bereiche: Gießfehler, Schweißfehler
Die transkristalline Korrosion kann besonders bei bestimmten Legierungen auftreten, bei denen sich während des Herstellungsprozesses bestimmte Phasen oder Ausscheidungen im Inneren der Kristallstrukturen bilden. Diese Ausscheidungen können dann während des Korrosionsprozesses bevorzugt angegriffen werden.

Korrosion durch mechanische Beanspruchung
Wir unterscheiden hier zwei Ausprägungen:
- Spannungsrisskorrosion
- Schwingungsrisskorrosion
Spannungsrisskorrosion – Erklärung
Spannungsrisskorrosion (auch unter dem Begriff “Stress Corrosion Cracking” oder SCC bekannt) ist eine spezielle Form der Korrosion, bei der ein metallisches Material in einer korrosiven Umgebung unter gleichzeitiger Belastung (Zugspannung) zu Rissen neigt. Diese Risse können sich rapide ausbreiten und letztendlich zum Bruch des Materials führen, selbst wenn die allgemeine Korrosion an der Oberfläche nicht stark ausgeprägt ist. Beispiel – Betroffene Bereiche: Brückenkonstruktionen
Schwingungsrisskorrosion – Erklärung
Schwingungsrisskorrosion (auch unter dem Begriff “Vibrational Fatigue Corrosion” bekannt) ist eine Art von Korrosion, die in Verbindung mit wiederholten Schwingungen oder Vibrationen eines Bauteils auftritt. Diese wiederholten Belastungen können zu Ermüdungsrissen führen, und wenn sie in einer korrosiven Umgebung auftreten, spricht man von Schwingungsrisskorrosion. Beispiel – Betroffene Bereiche: Schwingende Maschinen(-teile)
Korrosionsprodukte
Korrosionsprodukte sind Substanzen, die als Ergebnis des Korrosionsprozesses entstehen, bei dem Metalle mit ihrer Umgebung reagieren. Die genaue Natur der Korrosionsprodukte hängt von verschiedenen Faktoren ab, einschließlich des betroffenen Metalls, der Art der korrosiven Umgebung und anderer Einflüsse.

Hier sind einige häufige Korrosionsprodukte für bestimmte Metalle:
-
Eisen und Stahl (Rost): Die Korrosion von Eisen und Stahl führt zur Bildung von Eisenoxid, das im Volksmund als Rost bekannt ist. Rost hat eine rostbraune Farbe und kann das Metall schwächen, indem es eine lockere Schicht bildet, die die weitere Korrosion begünstigt.
-
Aluminium: Aluminium reagiert mit Sauerstoff in der Luft und bildet Aluminiumoxid. Dieses Oxid bildet eine dünne Schutzschicht, die das darunterliegende Aluminium vor weiterer Korrosion schützt.
-
Kupfer: Kupfer neigt dazu, grünliche Korrosionsprodukte zu bilden, wie zum Beispiel Kupferoxid und Kupfersulfat. Die Statue der Freiheitsstatue in den USA ist ein bekanntes Beispiel für die grüne Patina, die durch die Korrosion von Kupfer entsteht.
-
Zink: Zink korrodiert oft zu Zinkoxid. Die Bildung einer schützenden Oxidschicht auf der Zinkoberfläche kann die Korrosion verlangsamen.
-
Messing: Messing, eine Legierung aus Kupfer und Zink, kann durch die Korrosion der Zinkkomponente zu grünem Korrosionsprodukt führen. Die spezifische Farbe kann je nach den genauen Zusammensetzungen variieren.
-
Edelstahl: Edelstahl kann Korrosionsprodukte wie Eisenoxid, aber auch Chromoxid und Nickeloxid bilden. Diese Oxide können eine schützende Schicht bilden, die den Edelstahl vor weiterer Korrosion schützt.
Es ist wichtig zu beachten, dass die genauen Korrosionsprodukte von verschiedenen Faktoren abhängen, darunter die Art der korrosiven Umgebung, die Luftfeuchtigkeit, die Temperatur und die spezifischen Legierungsbestandteile des Metalls. Darüber hinaus können einige Metalle und Legierungen durch spezielle Beschichtungen oder Legierungen so behandelt werden, dass sie resistenter gegenüber Korrosion werden.
Korrosion – Mathematische Bestimmung
Vielleicht wunderst du dich an dieser Stelle, aber es ist wahr, dass man auch im Zusammenhang mit Korrosion Berechnungen anstellen kann. Hier kommen besonders zwei Formeln zur Anwendung:
- Korrosionsverlust
- Korrosionsgeschwindigkeit
Korrosionsverlust
Der Korrosionsverlust kann mathematisch durch die Berechnung des Materialabbaus oder der Materialdickenreduktion über einen bestimmten Zeitraum ausgedrückt werden. Die mathematische Darstellung hängt von verschiedenen Faktoren ab, einschließlich der Art der Korrosion, der aggressiven Umgebung und der spezifischen Eigenschaften des betroffenen Materials.
Hier sind einige grundlegende Ansätze:
-
Gleichmäßige Korrosion:
Wenn die Korrosion gleichmäßig über die gesamte Oberfläche eines Metalls erfolgt, kann der Korrosionsverlust (V) in Millimetern pro Jahr (mm/a) durch die Gleichung dargestellt werden:

Kennzahlen:
 Korrosionsverlust
Korrosionsverlust
 Korrosionsrate [in mm/a] – Wie viel Material geht pro Jahr verloren?
Korrosionsrate [in mm/a] – Wie viel Material geht pro Jahr verloren?
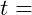 Zeit in Jahren
Zeit in Jahren
-
Lochfraßkorrosion oder lokale Angriffe:
Bei lokaler Korrosion, wie z.B. Lochfraßkorrosion, kann die Berechnung komplexer sein, da sie von verschiedenen Faktoren wie der Angriffsfläche und der spezifischen Form der Korrosion abhängt.
-
Gewichtsverlust:
In einigen Fällen wird der Korrosionsverlust auch in Form des Gewichtsverlusts ausgedrückt. Die Gleichung lautet:

Kennzahlen:
 Gewichtsverlust
Gewichtsverlust
 Materialdichte
Materialdichte
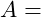 Fläche des betroffenen Materials
Fläche des betroffenen Materials
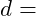 Materialdickenreduktion
Materialdickenreduktion
Diese Gleichungen sind allgemeine Ansätze und können je nach den spezifischen Gegebenheiten angepasst werden. Es ist wichtig zu beachten, dass Korrosion oft von vielen Faktoren beeinflusst wird, und die genaue Berechnung kann komplex sein. In der Praxis werden oft experimentelle Daten oder spezifische Modelle für die Korrosionsbewertung verwendet. Ingenieure und Materialwissenschaftler setzen verschiedene Methoden ein, um den Korrosionsverlust zu überwachen und zu bewerten.
Korrosionsgeschwindigkeit
Die Korrosionsgeschwindigkeit kann mathematisch durch die Korrosionsrate ausgedrückt werden. Die Korrosionsrate gibt an, wie viel Material pro Zeiteinheit durch Korrosion verloren geht und wird üblicherweise in Millimetern pro Jahr (mm/a) oder in Metern pro Jahr (m/a) angegeben.
Die mathematische Darstellung der Korrosionsgeschwindigkeit (Korrosionsrate) lautet:
![]()
Mit Formelzeichen:
![]()
Kennzahlen:
 Korrosionsrate [Verlust] in [mm/a oder m/a]
Korrosionsrate [Verlust] in [mm/a oder m/a] Verlust an Material [z.B. in Gramm]
Verlust an Material [z.B. in Gramm] Zeitverlauf [z.B in Jahren]
Zeitverlauf [z.B in Jahren]
Die Korrosionsrate kann durch verschiedene Methoden gemessen oder berechnet werden, einschließlich Gewichtsverlustmessungen, Dickenmessungen und anderen experimentellen Ansätzen. Die genaue Bestimmung der Korrosionsrate erfordert oft spezielle Tests und Analysen, da sie von vielen Faktoren abhängt, einschließlich der Art der Korrosion, der Zusammensetzung des Materials und der Umgebungsbedingungen.
Es ist wichtig zu beachten, dass die Korrosionsrate nicht immer konstant ist und in der Regel mit der Zeit variieren kann. Sie kann auch von Umweltbedingungen, wie Temperatur, Feuchtigkeit und der Art der korrosiven Substanzen, beeinflusst werden. Daher ist die genaue Berechnung der Korrosionsrate oft komplex und erfordert eine sorgfältige Analyse der spezifischen Umstände.
Beurteilung
Aus den Ergebnissen erhält man einen Zahlenwert, welcher Rückschlüsse zur Korrosionsbeständigkeit zulässt. So gilt folgendes:
- Werkstoffe mit einem Wert bis 2,4 = praktisch beständig
- Werkstoffe mit einem Wert von 2,4 – 24 = ziemlich beständig
- Werkstoffe mit einem Wert von 24 – 74 = nicht besonders beständig
Arten des Korrosionsschutzes
Korrosionsschutz bezieht sich auf eine Vielzahl von Maßnahmen und Techniken, die darauf abzielen, Materialien, insbesondere Metalle, vor den schädlichen Auswirkungen der Korrosion zu schützen. Der Zweck des Korrosionsschutzes besteht darin, die Lebensdauer von Bauteilen zu verlängern, ihre Integrität zu erhalten und letztendlich Kosten für Reparaturen oder Ersatz zu minimieren.
Hier sind einige allgemeine Erklärungen zu gängigen Korrosionsschutzmethoden:
-
Beschichtungen:
-
Farbanstriche und Lacke: Eine einfache Methode, um Metalle vor Korrosion zu schützen, besteht darin, sie mit Farbanstrichen oder Lacken zu beschichten. Diese Beschichtungen dienen als Barriere zwischen dem Metall und der korrosiven Umgebung.
-
Galvanisierung: Bei der Galvanisierung wird das Metall mit einer dünnen Schicht eines anderen Metalls, typischerweise Zink, beschichtet. Das Zink opfert sich durch Opferanodenschutz, wodurch das darunterliegende Metall geschützt wird.
-
-
Opferanoden:
- Opferanoden bestehen aus einem Metall, das opfern soll, um das zu schützende Metall zu erhalten. Zum Beispiel werden Zinkanoden oft in Verbindung mit Schiffsrümpfen oder unterirdischen Rohrleitungen eingesetzt, um das Stahlmaterial zu schützen.
-
Legierungen:
- Die Verwendung von korrosionsbeständigen Legierungen, wie Edelstahl, ist eine weitere Methode des Korrosionsschutzes. Diese Legierungen enthalten Elemente wie Chrom oder Nickel, die eine schützende Oxidschicht bilden und das darunterliegende Metall vor weiterer Korrosion schützen.
-
Kathodischer Schutz:
- Kathodischer Schutz nutzt elektrochemische Prinzipien, um das zu schützende Metall kathodisch zu polarisieren und so die Korrosion zu verhindern oder zu verlangsamen. Impressed Current Cathodic Protection (ICCP) und Sacrificial Cathodic Protection sind zwei gängige Methoden.
-
Besondere Beschichtungen:
- In einigen Fällen werden spezielle Beschichtungen wie Epoxidharze oder Polyurethanbeschichtungen verwendet, die besonders widerstandsfähig gegenüber aggressiven Umgebungen sind.
-
Regelmäßige Wartung:
- Regelmäßige Inspektionen, Reinigungen und Wartungsarbeiten sind entscheidend, um frühzeitig Korrosionsprobleme zu erkennen und zu beheben, bevor sie größere Schäden verursachen.
Der Korrosionsschutz ist in verschiedenen Industriezweigen von großer Bedeutung, darunter Bauwesen, Transportwesen, Energieerzeugung, Schiffbau und viele andere.
Aktiver Korrosionsschutz
Aktiver Korrosionsschutz bezieht sich auf eine Gruppe von Techniken und Methoden, die darauf abzielen, Materialien vor Korrosion zu schützen, indem sie gezielt elektrische oder elektrochemische Mittel einsetzen. Im aktiven Korrosionsschutz wird aktiv eingegriffen, um die elektrochemischen Reaktionen zu steuern, die zu Korrosion führen. Dieser Ansatz zielt darauf ab, das zu schützende Metall kathodisch zu polarisieren, um die Korrosion zu verhindern oder zumindest zu verlangsamen.
Aktiver Korrosionsschutz – Methoden:
-
Opferanoden (Zinkanoden): Opferanoden sind ein aktiver Korrosionsschutzmechanismus, bei dem ein Metall mit einer höheren elektrochemischen Spannung (opferndes Metall) dem zu schützenden Metall vorrangig korrodiert. Ein häufiges Beispiel sind Zinkanoden in Meerwasserumgebungen.
-
Impressed Current Cathodic Protection (ICCP): Dies ist eine aktive Form des kathodischen Schutzes, bei dem eine externe Stromquelle verwendet wird, um das zu schützende Metall kathodisch zu polarisieren.
-
Legierungen (besondere Legierungen mit opfernden Eigenschaften): In einigen Fällen werden spezielle Legierungen verwendet, die opfernde Eigenschaften aufweisen und so einen aktiven Schutz bieten.
Passiver Korrosionsschutz
Passiver Korrosionsschutz bezieht sich auf eine Gruppe von Techniken und Methoden, die darauf abzielen, Materialien vor Korrosion zu schützen, indem sie eine Schutzschicht oder Barriere bilden, um das Metall vor direktem Kontakt mit korrosiven Umgebungseinflüssen zu isolieren. Im Gegensatz zum aktiven Korrosionsschutz, der den elektrochemischen Prozess aktiv beeinflusst, setzt der passive Korrosionsschutz auf Schutzschichten, Beschichtungen oder spezielle Legierungen, um das Metall vor den schädlichen Auswirkungen der Korrosion zu bewahren.
Passiver Korrosionsschutz – Methoden:
-
Beschichtungen (Farbanstriche, Lacke, Epoxidharze): Diese bilden eine physikalische Barriere zwischen dem Metall und der korrosiven Umgebung. Sie verhindern den direkten Kontakt des Metalls mit Feuchtigkeit oder aggressiven Substanzen.
-
Legierungen (Edelstahl): Die Verwendung von korrosionsbeständigen Legierungen, wie Edelstahl, ist eine passive Methode. Diese Legierungen enthalten Elemente, die eine schützende Oxidschicht bilden und das darunterliegende Metall vor weiterer Korrosion schützen.
-
Spezielle Beschichtungen (Polyurethanbeschichtungen): Einige spezielle Beschichtungen bieten einen passiven Schutz, indem sie besonders widerstandsfähig gegenüber den Einflüssen der Umgebung sind.
-
Kathodischer Schutz (bei passiver Betriebsweise): Obwohl Kathodischer Schutz normalerweise als aktive Methode betrachtet wird, kann er in passiver Weise implementiert werden, wenn er als Opferanode dient.
In der Regel werden passive Korrosionsschutzmethoden bevorzugt, da sie weniger aufwendig in der Wartung sind. Aktive Methoden erfordern oft regelmäßige Überwachung und Wartung der Schutzsysteme. Die Auswahl zwischen aktiven und passiven Methoden hängt von den spezifischen Anforderungen der Anwendung, den Umgebungsbedingungen und den finanziellen Überlegungen ab. Oft werden auch Kombinationen beider Ansätze in komplexen Korrosionsschutzsystemen verwendet.
Nachdem wir uns mit dem Thema befasst haben, gehen wir im kommenden Kursabschnitt intensiv auf das Thema Korrosion ein.
Was gibt es noch bei uns?
Optimaler Lernerfolg durch tausende Übungsaufgaben

Quizfrage 1
Quizfrage 2
“Wusstest du, dass unter jedem Kursabschnitt eine Vielzahl von verschiedenen interaktiven Übungsaufgaben bereitsteht, mit denen du deinen aktuellen Wissensstand überprüfen kannst?”
Was ist Technikermathe?
Unser Dozent Jan erklärt es dir in nur 2 Minuten!
Oder direkt den > kostenlosen Probekurs < durchstöbern? – Hier findest du Auszüge aus jedem unserer Kurse!
Geballtes Wissen in derzeit 27 Kursen
Hat dir dieses Thema gefallen? – Ja? – Dann schaue dir auch gleich die anderen Themen zu den Kursen
WT3 (Werkstoffprüfung) und
TM1 (Technische Mechanik – Statik) an.


Perfekte Prüfungsvorbereitung für nur 14,90 EUR/Jahr pro Kurs
++ Günstiger geht’s nicht!! ++
Oder direkt Mitglied werden und Zugriff auf alle 27 Kurse (inkl. Webinare + Unterlagen) sichern ab 7,40 EUR/Monat ++ Besser geht’s nicht!! ++
Social Media? - Sind wir dabei!
Dein Technikermathe.de-Team






