Mehr zu diesem Thema und der Werkstofftechnik findest du im Kurs: WT3-Werkstoffprüfung
Als Kristallisation bezeichnet man den physikalischen Vorgang der Verhärtung bei der Bildung und beim Wachstum von Kristallen. Diesen Prozess kennzeichnet, dass die Kristallisationsenthalpie freigesetzt wird. Zur Beschleunigung der Kristallisation werden bei der Züchtung von Kristallen künstliche Bedingungen (Impfen) geschaffen.
Grundlagen zur Kristallisation (Aggregatszustände)
Metalle können in 4 unterschiedlichen Aggregatszuständen auftreten.
Wir unterscheiden
- Plasma,
- Gas,
- Flüssigkeit und
- Feststoff
voneinander.
Aus metallurgischer Sicht besteht der größte Unterschied zwischen diesen Zuständen darin, dass die Ordnung der Bausteine ausgehend von der obigen Liste immer weiter zunimmt. Ist die Ordnung bei einem Metall als Plasma noch am geringsten, so ist die Ordnung als Feststoff maximal.
Plasma
Im Plasma bewegen sich die Atomkerne als auch die Elektronen unabhängig voneinander und folgen dabei keinem Muster.
Gas und Flüssigkeit
Innerhalb dieser beiden Aggregatszustände nimmt die Ordnung der Atomkerne und Elektronen fortschreitend zu.
Feststoff
Erreicht das Metall den Zustand als Feststoff so wird die maximale Ordnung erreicht.
Im Gegensatz zur Urformtechnik befasst sich die Werkstofftechnik vorrangig mit Metallen als Feststoffe.
Trotzdem sollte jedem bewusst sein, dass der feste metallische Werkstoff früher mal aus dem gasförmigen oder flüssigen Zustand erschaffen wurde.
Phasen
Um den Zustand eines Stoffes zu beschreiben, genügt es nicht einfach nur den Aggregatszustand zu kennen. Um die Eigenschaften eines Werkstoffes auch wirklich zu verstehen müssen wir uns die Phasen und die Einteilung in einphasige oder mehrphasige Stoffsysteme genau anschauen.
Phasen sind Stoffe die zwar unterschiedliche Zustände aufweisen können, aber dafür in sich homogen sind. Dabei meint homogen, dass eine einheitliche Substanz in Hinblick auf Zusammensetzung und Atomanordnung vorliegt.
Phasen stellen ein abgegrenztes Volumen mit gleichen chemischen und physikalischen Eigenschaften dar.
Durch eine Grenzfläche werden sie von anderen Phasen mit anderen Zusammensetzungen und Atomanordnungen getrennt.
Arten von Phasen
Wir unterscheiden drei Formen von Phasen:
- Gasförmige, flüssige und feste Phasen
- Lösungsphasen wie Mischkristalle
- Verbindungsphasen
Ein stoffliches System (Werkstoff) kann sogar nur aus einer einzigen Phase bestehen. In Normalfall finden sich jedoch immer unterschiedliche Phasen im System wieder.
Ob Phasen einzeln oder in einer Gleichgewichtslage nebeneinander vorliegen, entscheidet sich daran wie die Zustandsgrößen Druck und Temperatur auf den Stoff einwirken. Dabei ist im ersten Schritt auch nicht relevant welcher Aggregatszustand vorliegt.
Temperatur
Besonders der Temperatur kommt hier eine bedeutende Rolle zu. Denn jede Abweichung von der Temperatur T = 0 Kelvin bewirkt, dass sich die Atome aus ihrer Ruhelage entfernen.
Steigt die Temperatur so nimmt auch die Schwingung der Atome im Gitter der Metalle zu.
Es erfolgt eine Energieumwandlung von Wärmeenergie in Schwingungsenergie. Diese innere Energie sorgt für eine Vergrößerung der Abstände der Mittellagen der Atome, wodurch sich der Körper letztlich ausdehnt. Eine Senkung der Temperatur hingegen erzeugt den umgekehrten Effekt und das Metall zieht sich wieder zusammen.
Schmelztemperatur
Mit dem Erreichen der Schmelztemperatur, steigt die Temperatur trotz fortlaufender Wärmeenergiezufuhr nicht weiter an. Sie stagniert zunächst. Auch beim Übergang vom flüssigen Zustand in den gasförmigen Zustand lässt sich dieses Phänomen beobachten.
In der nächsten Abbildung ist dieser Effekt grafisch verdeutlicht:
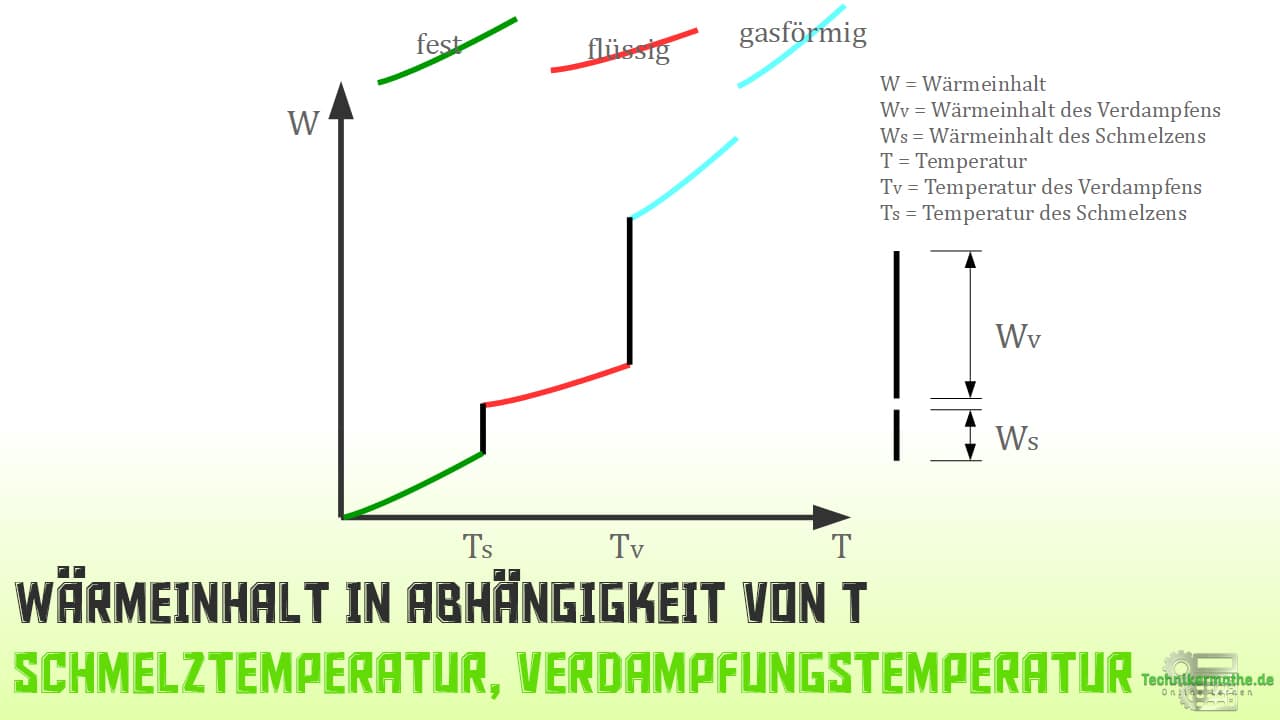
Hier wird beim Übergang des Zustandes fest in den Zustand flüssige die Energie als Schmelzwärme benötigt, um die Bindungskräfte zu überwinden, die bisher die Kristallstruktur aufrecht gehalten haben.
Beim Übergang flüssige in gasförmig wird die Energie als Verdampfungswärme verwendet, um die Gasphase zu erreichen.
Sowohl die Schmelzwärme (Schmelzenergie) als auch die Verdampfungswärme (Verdampfungsenergie) werden bei einer Abkühlung freigesetzt und halten die Temperatur so lange konstant, bis die Phasenumwandlung letzten Endes abgeschlossen ist.
Phasenumwandlung Gasförmig-fest
Diese Phasenumwandlung wird auch als Sublimation bezeichnet. Hier wird der Zwischenschritt des flüssigen Zustandes ausgelassen.
In der Fertigungstechnik oder der Beschichtungstechnik wird diese Form der Umwandlung verwendet, um beispielsweise dünne Metallfolien zu erzeugen oder Bauteile zu beschichten.
Denn liegt ein geringer Gasdruck vor und erfolgt die Abkühlung ausreichend schnell, so kann aus dem Metalldampf auf einer metallischen Oberfläche eine feste Schicht erzeugt werden.
In der Industrie finden sich zwei relevante Verfahren, die diese Phasenumwandlung nutzen:
- Thermische Verdampfung im Vakuumofen
- Kathodenzerstäubung
Phasenumwandlung Flüssig-fest
Diese Art der Phasenumwandlung (Kristallisation) ist der Normalfall bei der Erzeugung von metallischen Feststoffen.”
Hier wird die Metallschmelze langsam abgekühlt. Mit dem Erreichen einer bestimmten Temperatur tritt mit dem Haltepunkt die Haltezeit ein. Hier verbleibt die Schmelze auf einem vorgegebenen Temperaturniveau. Dieses Temperaturniveau bezeichnet man als Erstarrungstemperatur.
Beispiele für typische Erstarrungstemperaturen sind nachfolgend aufgeführt:
- Zinn: 232 °C
- Blei: 327 °C
- Zink: 419 °C
- Aluminium: 660 °C
- Kupfer: 1083 °C
- Eisen: 1536 °C
- Wolfram: 3387 °C
Die Erstarrungstemperatur ist selbstverständlich auch gleichzeitig die Schmelztemperatur.
Konstant bleibt die Temperatur, weil in Folge der Erstarrung Schmelzwärme freigesetzt wird.
Sobald die Erstarrung abgeschlossen ist, sinkt die Temperatur weiter.
Haltezeit
In der nachfolgenden Abbildung ist der gesamte Vorgang der Haltezeit schematisch dargestellt:
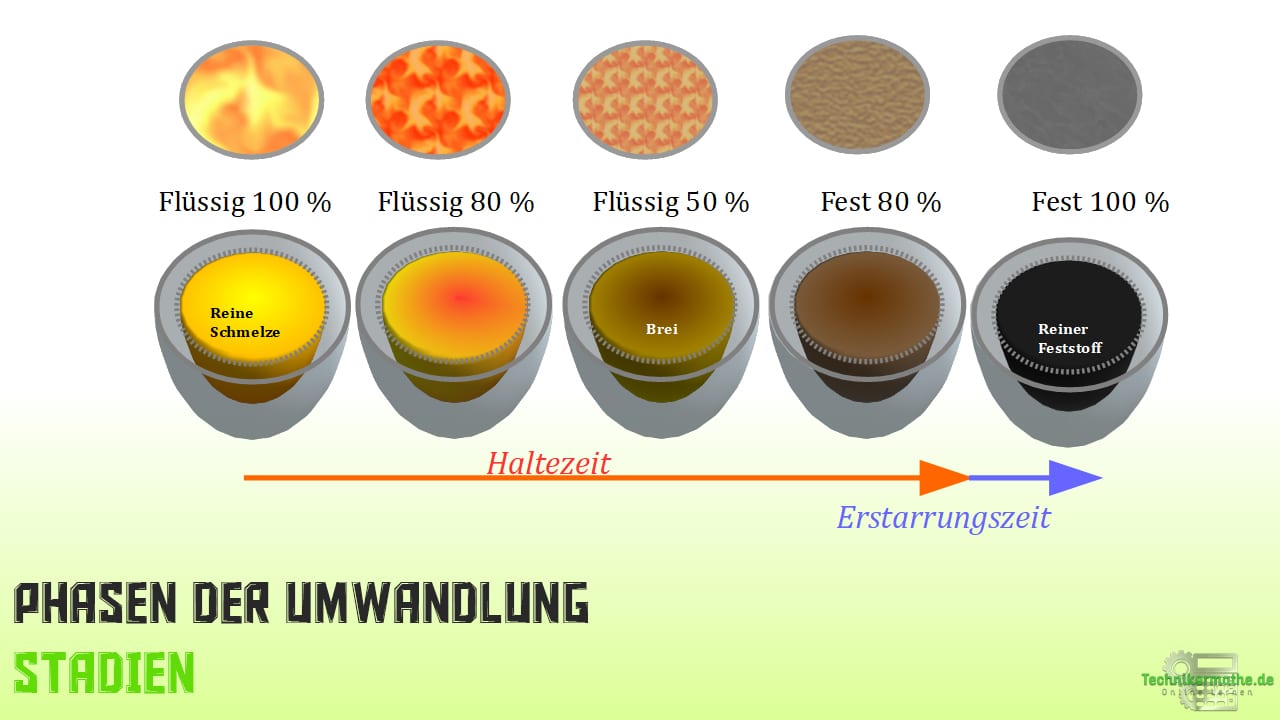
- Das Metall liegt vollkommen flüssig vor.
- Start der Haltezeit und der Erstarrung. Innerhalb der Schmelze bilden sich kleine feste Bereiche (Kristalle). Erste Gitteranordnungen.
- Die Schmelze gleicht nun einem Brei. Dabei liegt die Verteilung zwischen flüssigem und festem Bereich ungefähr bei 50:50.
- Die Schmelze ist weitestgehend erstarrt, nur noch vereinzelt finden sich schmelzflüssige Bereiche wieder.
- Die Haltezeit endet und das Metall liegt vollständig fest mit kristallinem Gefüge vor. Die Kristallisation ist abgeschlossen.
Diese Phasenumwandlung ist natürlich kein Selbstläufer und birgt immer die Gefahr von Fehlern. Wird die Schmelze zu schnell abgekühlt, so besteht immer die Gefahr, dass der Haltepunkt verpasst oder gar nicht erreicht wird.
Kristallisation
“Die Kristallisation ist der gesamte Erstarrungsvorgang.”
++ Videoclip – Kristallisation ++
Mit dem Erreichen des Haltepunktes beginnen sich in der Schmelze Bereiche zu beiden, in denen sich die Atome in einem Gitter anordnen. Man spricht bei diesen Bildungen von Keimen.
Die Keime wachsen als Kristalle wie Organismen in alle Richtungen, indem sich die noch freien Atome in der Schmelze an den Keimen, also im Gitter anordnen.
Ab dem Zeitpunkt indem alle Kristalle aneinanderstoßen ist die Schmelze aufgezerrt und die Erstarrung abgeschlossen.
Der gesamte Vorgang der Kristallisation ist in der nachfolgenden Abbildung veranschaulicht.

Das vorliegende Kristallgefüge ist dann entweder polykristallin oder quasiisotrop.
Keimbildung
Die oben beschriebene Keimbildung kann zwei Ausprägungen annehmen.
- Homogene Keimbildung: Eigenkeimbildung – Reine Stoffe
- Heterogene Keimbildung: Fremdsubstanzen – Legierungen, Begleiter oder Verunreinigungen
Einflussfaktoren der Kristallisation
Wie erfolgreich und gewünscht Kristallisation abläuft, steht und fällt mit der Anzahl der Keime und der Kristallisationsgeschwindigkeit.
Davon hängen dann die Korngröße des Gefüges und letztlich die mechanischen Eigenschaften des Werkstoffes ab.
Feinkorn
Im Normalfall wird ein feinkörniges Gefüge gefordert. Um diesen Zustand zu erreichen nutzt man entweder eine rasche Abkühlung der Schmelze, um viele Keime zu erhalten oder man fügt zusätzlich Fremdkeime, bzw. Substrate, die das Keimwachstum antreiben, der Schmelze hinzu, welche ihren Oberflächenenergie zur Keimbildung beitragen. Diesen letzten Vorgang bezeichnet man als Impfen der Schmelze.
Die Rasche Abkühlung als erste Variante der Feinkornbildung gelingt durch das Gießen der Schmelze in gekühlte oder ungekühlte Metallformen. Alternativ verwendet man den Druck- oder Schleuderguss, die ebenfalls eine zügige Wärmeableitung an der Luft ermöglichen.
Grobkorn
Das Grobkorn stellt sich bei Werkstoffen ein, die langsam abgekühlt werden. Möglicher Nachteil dieser Vorgehensweise ist, dass darunter auch die Festigkeit des Werkstoffes leidet.
Die verlangsamte Abkühlung als Variante der Grobkornbildung gelingt durch das Gießen der Schmelze in Sandformen. Alternativ verwendet man zusätzliche Thermoelemente, die ein längeres Warmhalten ermöglichen.
Darstellung von Feinkorn und Grobkorn
Nachfolgend findest du noch mal eine Darstellung von einem Feinkorn und einem Grobkorn als Schema:

Nachdem du jetzt einen Überblick zur Kristallisation erhalten hast, gehen wir im kommenden Kursabschnitt ausführlich auf die elastische und plastische Verformung im Detail ein.
Was gibt es noch bei uns?
Optimaler Lernerfolg durch tausende Übungsaufgaben

Quizfrage 1
Quizfrage 2
“Wusstest du, dass unter jedem Kursabschnitt eine Vielzahl von verschiedenen interaktiven Übungsaufgaben bereitsteht, mit denen du deinen aktuellen Wissensstand überprüfen kannst?”
Was ist Technikermathe?
Unser Dozent Jan erklärt es dir in nur 2 Minuten!
Oder direkt den > kostenlosen Probekurs < durchstöbern? – Hier findest du Auszüge aus jedem unserer Kurse!
Geballtes Wissen in derzeit 26 Kursen
Hat dir dieses Thema gefallen? – Ja? – Dann schaue dir auch gleich die anderen Themen zu den Kursen
WT3 (Werkstoffprüfung) und
TM1 (Technische Mechanik – Statik) an.


Perfekte Prüfungsvorbereitung für nur 14,90 EUR/Jahr pro Kurs
++ Günstiger geht’s nicht!! ++
Oder direkt Mitglied werden und Zugriff auf alle 26 Kurse (inkl. Webinare + Unterlagen) sichern ab 7,40 EUR/Monat ++ Besser geht’s nicht!! ++
Social Media? - Sind wir dabei!
Dein Technikermathe.de-Team






