Zink ist ein sprödes Metall mit bläulich-blassgrauem Glanz, welches zum Verzinken von Eisen und Stahl verwendet wird. Auch für Mensch und Tier ist es lebenswichtig als Bestandteil einiger Enzyme. Auch für die Herstellung von Wasserstoff wird dieses Metall genutzt.“

Was ist Zink?
Definition
Zink ist ein chemisches Element mit dem Symbol Zn und der Ordnungszahl 30. Es gehört zur Gruppe der Übergangsmetalle und zeichnet sich durch seine Korrosionsbeständigkeit sowie seine Rolle als lebensnotwendiges Spurenelement aus. Das Metall ist bläulich-weiß, spröde bei Raumtemperatur, aber bei mäßiger Erwärmung verformbar. Seine Hauptanwendung liegt im Korrosionsschutz von Stahl durch Verzinkung sowie in der Legierungsbildung, insbesondere in Messing.
Ab dem 14 Jahrhundert wurde es als eigenständiges Material in Indien verwendet.
Zink Eigenschaften – Wichtige Fakten auf einen Blick
| Eigenschaft | Wert |
|---|---|
| Ordnungszahl | 30 |
| Atommasse | 65,38 u |
| Schmelzpunkt | 419,53 °C |
| Siedepunkt | 907 °C |
| Dichte | 7,14 g/cm³ |
| Elektrische Leitfähigkeit | 16,7 × 10⁶ S/m |
| Wärmeleitfähigkeit | 120 W/(m·K) |
| Gitterstruktur | Hexagonal |
| Verformbarkeit | Spröde bei RT, duktil ab 120 °C |
Vorkommen und Weltmarkt von Zink
Zink ist eines der häufigsten Metalle in der Erdkruste und liegt dort meist in gebundener Form vor. Die wichtigsten Zinkmineralien sind:
-
Zinksulfid (ZnS) – Hauptquelle für die industrielle Gewinnung
-
Zinkspat (ZnCO₃) – Nebenquelle
-
Kieselzinkerz (Zn₄(OH)₂[Si₂O₇]·H₂O)
Förderung und Produktion
Jährlich werden weltweit ca. 13,4 Mio. Tonnen Zink gefördert. Weitere 14 Mio. Tonnen stammen aus Recycling-Kreisläufen.
Die größten Produzentenländer:
-
China: 5,1 Mio. t
-
Peru: 1,4 Mio. t
-
Australien, Kanada, USA
Die größten bekannten Zinkreserven finden sich in:
-
Australien: 64.000 t
-
China: 41.000 t
-
Peru: 28.000 t
Der aktuelle Marktpreis für Zink liegt bei ca. 1350 EUR/t.

- Die Gitterstruktur ist hexagonal.
sowie
- In Kontakt mit der Umgebungsluft reagiert es mit Sauerstoff und bildet an der Oberfläche eine beständige sowie dichte Oxidschicht aus. Die Reaktion mit heißem Wasser fällt äußerst stark aus und in Verbindung mit Sauerstoff sowie Flammen ist es entzündlich.
sowie
- Die Dichte beträgt
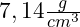 . Somit zählt es zu den Schwermetallen und eignet sich hervorragend für Legierungen.
. Somit zählt es zu den Schwermetallen und eignet sich hervorragend für Legierungen.
sowie
- Der Schmelzpunkt liegt bei 419,53 °C und die Siedetemperatur liegt bei 907 °C
sowie
- Die elektrische Leitfähigkeit beträgt
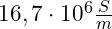 [S = Siemens, m = Leiterlänge]
[S = Siemens, m = Leiterlänge]
sowie
- Die Zugfestigkeit liegt bei der Reinform bei
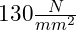 .
.
sowie
- Bei Raumtemperatur ist das Metall spröde, jedoch ab einer Temperatur von 120 °C wird es duktil und gut formbar.
sowie
- Der E-Modul (Elastizitätsmodul) liegt bei ca. 95 GPa und bei gewalztem Zink bei ca. 120 GPa.
sowie
- Die Wärmeleitfähigkeit ist mit
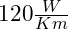 vergleichsweise mittelmäßig.
vergleichsweise mittelmäßig.
Es ist auch ein sehr wichtiger Bestandteil der Enzyme (in 200 verschiedenen) in unserem Körper und den Körper aller Lebewesen. Fleisch, Käse, Kürbiskerne, Linsen und weitere Lebensmittel enthalten das Metall als Spurenelement. Besonders Erdnüsse enthalten relativ viel dieses Metalls.
Zink Herstellung
Oxidgewinnung durch Röstung
Zink liegt in der Natur meist als Zinksulfid (ZnS) vor. Durch Röstung wird es in Zinkoxid (ZnO) umgewandelt:
![]()
Alternativ kann auch Zinkspat (ZnCO₃) durch Brennen in Zinkoxid umgewandelt werden:
![]()
Reduktion zu metallischem Zink
Es gibt zwei Hauptverfahren zur Reduktion von Zinkoxid zu metallischem Zink:
1. Verhüttung (Thermisches Verfahren)
-
Prozesstemperatur: 1100 – 1300 °C
-
Reduktion durch Kohlenstoff:
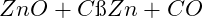
-
Das entstehende gasförmige Zink kondensiert zu Rohzink (~98 % Reinheit)
-
Reinigung durch fraktionierte Destillation
2. Elektrolyse (Nasses Verfahren)
-
Zinkoxid wird in Schwefelsäure gelöst
-
Elektrolyse an Aluminiumkathoden
-
Nach 24 h Abziehen des Zinks
-
Reinigung durch Umschmelzen
Zinkoxid
Wir bereits erwähnt liegt uns der Rohstoff in Form von Zinksulfid und -spat vor. Für eine weitere Verarbeitung benötigen wir jedoch die Oxidform. Um dieses aus der jeweiligen Rohstoffform gewinnen zu können, nutzt man zwei unterschiedliche Verfahren.
Zinksulfid
Um das Oxid aus Zinksulfid zu erhalten, röstet man dieses. Die chemische Reaktionsgleichung hierfür ist:
![]()
Zinkspat
Um Oxid aus Zinkspat zu erhalten, brennt man dieses. Hier ist die chemische Reaktionsgleichung folgende:
Hier findet die Reaktion bei einer Prozesstemperatur von 1100-1300 °C statt. Als Reaktionsraum dient dabei ein Muffelofen. Da das Metall bei einer Temperatur von 908 °C in den gasförmigen Aggregatszustand übergeht, liegt es im Ofen gasförmig vor. Dadurch wird die Reaktion zwar beschleunigt, jedoch neigt es im gasförmigen Zustand zur Tröpfchenbildung und in Kontakt mit der Umgebungsluft bildet sich eine Oxidschicht aus, womit wir durch diese Rückreaktion erneut beim Zinkoxid wären. Deshalb gilt es einen Kontakt mit Sauerstoff gänzlich zu vermeiden. Ein hingegen willkommener Reaktionspartner ist hingegen Kohle, bzw. das bei der Verhüttung von diesem und anderen Metallen sich bildende Kohlenmonoxid. Im Boudouard-Gleichgewicht kann es als Gas an der gesamten Oberfläche des Erzes reduzieren. Dabei steht (s) = solid (fest) und (g) = gas (gasförmig) Das Boudouard-Gleichgewicht ist wie folgt: Daraus erhält man, Der Gehalt des Rohmetalls liegt nach Abschluss der Verhüttung bei ca. 98%. Aufgrund der noch in der Rohform befindlichen Nebenprodukte wie Eisen, Blei, Cadmium sowie Arsen, schließt sich an die Verhüttung zumeist eine Reinigung an. Diese erfolgt über eine zweischrittige fraktionierende Destillation. Denn jedes Metall besitzt einen unterschiedlichen Siedepunkt, der uns hier zum Nutzen wird. Leider liegt der Siedepunkt von Cadmium (767,3 °C) unterhalb von Rohzink (908,5 °C), weshalb diese zuerst gemeinsam von den anderen Fraktionen Blei (1751 °C) und Eisen (3070 °C) getrennt werden müssen. Bei einer Prozesstemperatur unterhalb von 1500 °C verbleiben Blei und Eisen im Rückstand. Cadmium und Rohzink haben sich verflüchtigt und kondensieren anschließend. Uns liegt jetzt ein eisen- und bleifreies Metall vor, das in zweiten Destillationsschritt zusammen mit dem Cadmium soweit erhitzt wird, dass das Cadmium sich verflüchtigt und das Feinzink mit einer Reinheit von 99,99 % in flüssiger Form zurückbleibt. Abschließend kühlt man die Schmelze wieder ab und verarbeitet sie weiter. Bei der Elektrolyse wird das Oxid in einer Zinksulfatlösung mit Schwefelsäure extrahiert. Durch die Elektrolyse sammelt sich das Elektrolytzink an den Aluminiumkathoden an und wird alle 24 Stunden abgezogen. Die Anoden bestehen aus Blei. Anschließend kann das es umgeschmolzen werden. Feuerverzinkung: Eintauchen in geschmolzenes Zink Galvanisches Verzinken: Elektrochemische Abscheidung Kathodischer Schutz: Selbst wenn die Zinkschicht beschädigt wird, schützt sie das darunterliegende Metall Messing (Cu-Zn): Hohe Festigkeit, dekorative Optik Neusilber (Cu-Ni-Zn): Härter als Messing, korrosionsbeständig Zink-Aluminium-Legierungen: Hohe Festigkeit, niedrige Dichte Batterien: Zink-Kohle- und Alkali-Mangan-Zellen Pigmente: Zinkoxid in Farben und Kunststoffen Pharma & Medizin: Zinksalben zur Wundheilung Hauptsächlich dient es zum Schutz vor Korrosion. Selbst wenn Bereiche des Metalls nicht von einer Schicht überzogen sind, wird es durch die Fernwirkung geschützt. Dies ist eine Eigenschaft, die dieses Metall besonders auf den Außeneinsatz so attraktiv macht. Zudem wird das Metall in Zink-Mangan-Zellen eingesetzt und geht somit als Bestandteil in Batterien ein. Als Legierungselement kann es maßgeblich Einfluss auf die Beständigkeit von anderen Metallen nehmen indem es bestimmte Eigenschaften verstärkt und störende Eigenschaften unterdrückt. So kann es auch genutzt werden, um Gold oder Silber aus bestehenden Legierungen abzutrennen. Nennenswerte Legierungen sind: Kupfer-Zink-Legierungen (CuZn): Messing Kupfer-Nickel-Zink-Legierungen (CuNiZn): Neusilber In erster Linie nutzt man es als Überzugsmaterial. Ihm kommt im Stahl- und Maschinenbau die Aufgabe des Korrosionsschutzes von Eisen und Stahl zu. Als Konstruktionswerkstoff wird des für Anoden sowie Druckplatten in galvanischen Elektrolysezellen verwendet. Auch in der Bauwirtschaft wird das Metall als Titanzink verwendet. Beispiele für die Verwendung im Bauwesen sind: sowie sowie sowie Weitere Beispiele bei denen das Metall eingesetzt wird: sowie sowie Im Solznic-Verfahren nutzt man das Metall zur Erzeugung von Wasserstoff. In zwei Schritten wird Zinkoxid zuerst durch Wärmeeinfluss (Sonne) in Zink und Sauerstoff aufgetrennt und anschließend das Metall zusammen mit Wasser zu dem Oxid und Wasserstoff umgewandelt. Dank des Metalls wird das Wasser aufgespalten. Eine verzinkte Stahltreppe im Außenbereich bleibt über Jahrzehnte rostfrei, da Zink als Opferanode wirkt und das darunterliegende Eisen schützt. Trompeten und Posaunen bestehen aus Messing – einer Legierung aus Kupfer und Zink. Dies verleiht ihnen eine hohe Korrosionsbeständigkeit und einen warmen Klang. 100 g Erdnüsse enthalten etwa 6 mg Zink – ein wichtiger Beitrag zur täglichen Zinkversorgung für den menschlichen Körper. Zink dient primär als Korrosionsschutz für Stahl, in Legierungen (Messing, Neusilber) und als essentielles Spurenelement in der Ernährung. Zink wirkt als Opferanode: Es reagiert mit Sauerstoff, bevor das darunterliegende Eisen oxidiert. Die empfohlene Tagesdosis beträgt: Männer: 10 mg Frauen: 7 mg Schwangere: 10–13 mg Ja. Eine Überdosierung kann zu Magen-Darm-Beschwerden, Immunschwäche und Kupfermangel führen. Ja! Zink ist zu über 90 % recycelbar – insbesondere aus Schrott und verzinktem Stahl. Zink ist ein vielseitig einsetzbares Übergangsmetall, das sowohl in der Industrie als auch in der Biologie eine essenzielle Rolle spielt. Seine Korrosionsbeständigkeit macht es zum idealen Werkstoff für den Schutz von Stahl. Zudem bildet es die Grundlage für zahlreiche Legierungen wie Messing und Neusilber. Dank seiner Rolle als essentielles Spurenelement ist es auch für den menschlichen Stoffwechsel unverzichtbar. Die industrielle Zinkproduktion erfolgt über Verhüttung oder Elektrolyse, während das Recycling einen wachsenden Anteil an der Gesamtproduktion ausmacht. Mit diesen umfassenden Informationen bist du bestens über Zink informiert – von seinen chemischen Eigenschaften über seine Gewinnung bis hin zu seinen zahlreichen Einsatzmöglichkeiten! 🚀 Quizfrage 1 Quizfrage 2 “Wusstest du, dass unter jedem Kursabschnitt eine Vielzahl von verschiedenen interaktiven Übungsaufgaben bereitsteht, mit denen du deinen aktuellen Wissensstand überprüfen kannst?” Unser Dozent Jan erklärt es dir in nur 2 Minuten! Oder direkt den > kostenlosen Probekurs < durchstöbern? – Hier findest du Auszüge aus jedem unserer Kurse! Hat dir dieses Thema gefallen? – Ja? – Dann schaue dir auch gleich die anderen Themen zu den Kursen WT3 (Werkstoffprüfung) und Perfekte Prüfungsvorbereitung für nur 14,90 EUR/Jahr pro Kurs ++ Günstiger geht’s nicht!! ++ Oder direkt Mitglied werden und Zugriff auf alle 26 Kurse (inkl. Webinare + Unterlagen) sichern ab 7,40 EUR/Monat ++ Besser geht’s nicht!! ++
Dein Technikermathe.de-Team ![]()
Verhüttung von Zinkoxid – Verfahren
![]()
![]()
![]()
Destillation – Schritt 1
Destillation – Schritt 2
Elektrolyse von Zinkoxid – Verfahren
Wichtige Anwendungsbereiche von Zink Verwendung
1. Korrosionsschutz (Verzinken von Stahl)
2. Legierungen mit Zink
3. Elektronik & Chemie
Legierungen
Reinform
Anschauliche Beispiele für Zinkanwendungen
Beispiel 1: Verzinkte Treppe
Beispiel 2: Messinginstrumente
Beispiel 3: Zink als Spurenelement in der Ernährung
Mögliche Fragestellungen | Häufig gestellte Fragen (FAQs)
1. Wofür wird Zink hauptsächlich verwendet?
2. Warum schützt Zink Stahl vor Rost?
3. Wie viel Zink braucht der Mensch täglich?
4. Ist zu viel Zink schädlich?
5. Kann man Zink recyceln?
Zusammenfassung
Was gibt es noch bei uns?
Optimaler Lernerfolg durch tausende Übungsaufgaben
Was ist Technikermathe?
Geballtes Wissen in derzeit 26 Kursen
TM1 (Technische Mechanik – Statik) an. 

Social Media? - Sind wir dabei!








