In diesem Kurstext erklären wir dir als angehenden Techniker ausführlich wie die Polymerisation abläuft und was es hier zu beachten gilt.
“Dieses Verfahren ist neben der Polykondensation und Polyaddition eine Variante der Polyreaktion bei der aus Monomeren Polymere werden.”

Diese Art der Kunststofferzeugung ist eine der gängigsten Syntheseformen zur Herstellung von Kunststoffen, die wir für unser tägliches Leben benötigen. Die Voraussetzung dafür, dass diese ablaufen kann, liegt im Aufbau der Monomere. Denn diese müssen mindestens eine Doppelbindung (z. B. Doppel-C-Bindung) aufweisen, damit sie während der Kettenreaktion untereinander verbunden werden können.
Polymerisation – Grundlagen
Beim Prozess der Polymerbildung werden identische, niedermolekulare Monomere (Verbindungen mit Doppelbindungen) zu Makromolekülen aggregiert (zusammengefasst).
In erster Linie entstehen dabei Ringverbindungen sowie C-Doppelverbindungen.
Indem man dem System Energie zuführt, wie beispielsweise Wärme startet die Reaktion infolge dieser Aktivierung.
Dabei öffnen sich die Doppelbindungen der Monomere, wodurch reaktionsfähige Radikale entstehen.
Am Ende erhält man lange Ketten von Polymeren.
Die Anzahl der Monomere (Grundmoleküle) in einem Polymer (Makromolekül) erfasst man mit dem Polymerisationsgrad n.
Denn dieser ist ein Maß für die durchschnittliche Kettenlänge und die durchschnittliche relative Molekülmasse.
Zudem kennzeichnet den Polymerisationsgrad, dass er die mechanischen Eigenschaften eines Werkstoffs bestimmt.
Der gesamte Vorgang ist nochmals auf dem nachfolgenden Bild zu sehen.
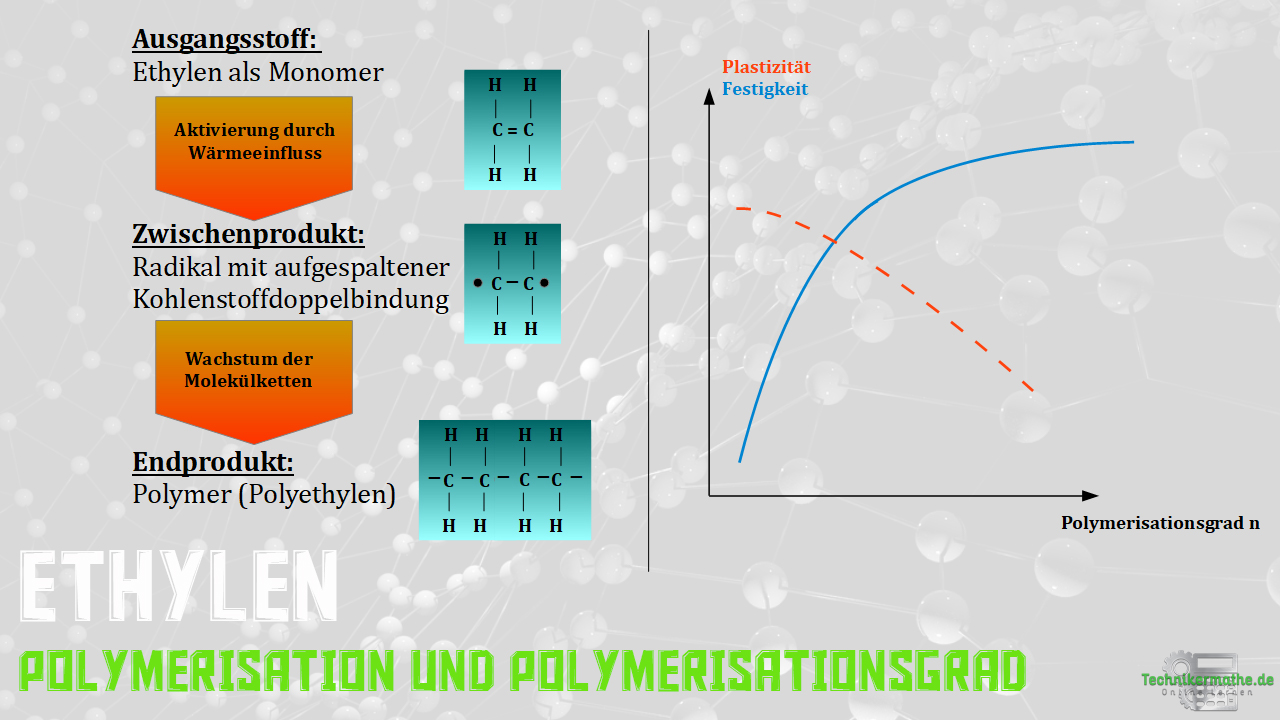
Auf dem linken Teil der Abbildung siehst du die Entstehung von Ethylen sowie auf dem rechten Teil der Abbildung die Abhängigkeit der Festigkeit und Plastizität vom Polymerisationsgrad n (Kettenlänge).
Polymerbildung – Substanz versus Lösung
Die oben erwähnte Kohlenstoff-Doppelbindung liegt instabil vor. Um daraus eine stabilere Kohlenstoff-Einfachbindung zu erhalten, muss eine exotherme Polymerisation anlaufen.
Problematisch ist bei der Polymerisation in Substanz ist, dass die Kettenreaktion zu einer stark erhöhten Reaktionstemperatur führen kann, die wiederum in einer Polymerisation mit geringem Polymerisationsgrad mündet.
Daher empfiehlt sich diese Variante nur, wenn die Reaktionsgeschwindigkeit der Kettenreaktion stark reduziert wird.
Viel einfacher stellt sich die Polymerisation in einer Lösung dar. Hier hat man das Problem der erhöhten Reaktionstemperatur nicht, weshalb diese Variante bevorzugt, eingesetzt wird.
Stufen – Ablauf
Nachfolgend entdeckst du die Stadien sowie die Prozessreaktionen aufgelistet.
Stadien
Der einfache Ablauf, bzw. die Stadien der Polymerisation ist weitestgehend identisch, unabhängig davon ob es in Substanz oder in Lösung stattfindet
- Mit der Hinzugabe eines Katalysators wird die Polymerisation in Gang gesetzt.
- Der Katalysator (Wärme) öffnet die C-Doppelbindung der Monomere
- Als Zwischenprodukt erhalten wir Radikale, bei denen die C-Doppelbindung aufgespalten ist.
- Diese Radikale verbinden sich über die C-Einfachbindung miteinander und Polymere entstehen.
- Die Kettenreaktion endet zu dem Zeitpunkt, an dem keine Monomere und Radikale mehr vorhanden sind.
Prozessreaktionen
Diese 5 Punkte können in drei Prozessreaktionen zusammengefasst werden. Denn aus chemischer Sicht haben wir
- Die Startreaktion (entspricht 1. Oben)
- Die Wachstumsreaktion (entspricht 2.-4. Oben)
- Abbruchreaktion (entspricht 5. Oben)
Aufbau von PVC – Beispiel
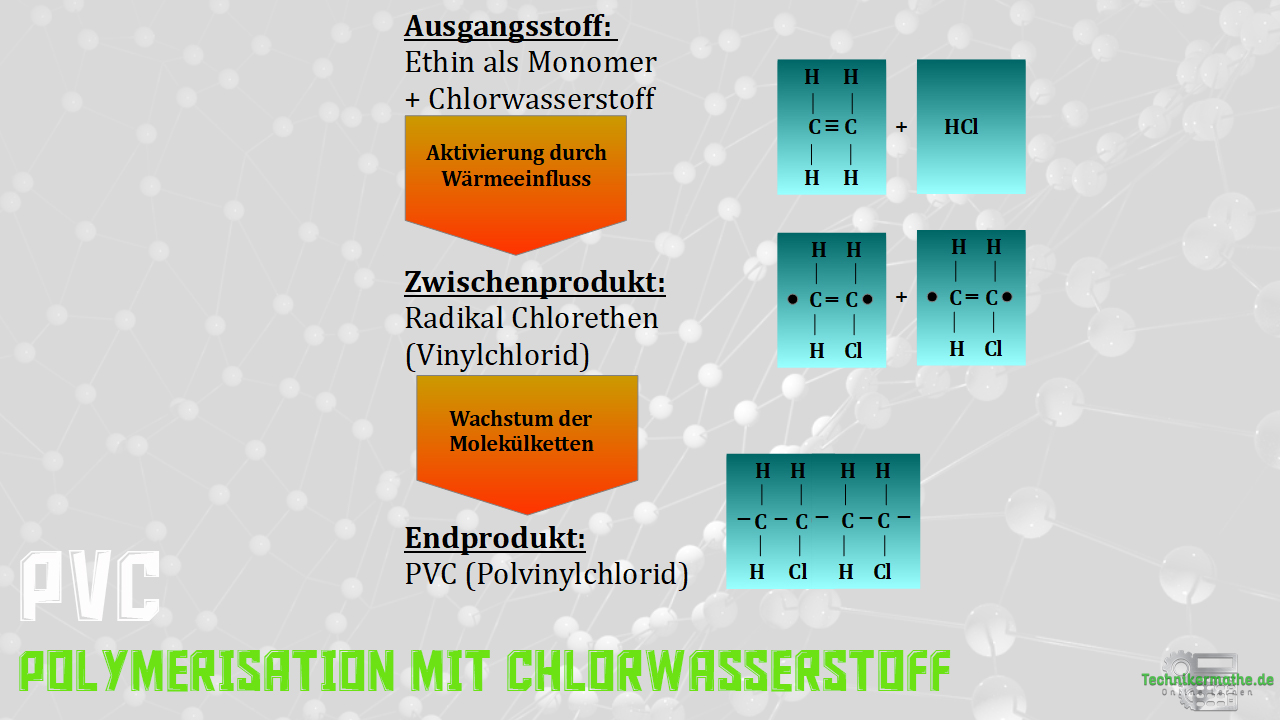
Nachdem du nun einiges über die Entstehung von Polymeren erfahren hast, stellen wir dir in den kommenden drei Kurstexten nacheinander die radikale, ionische, sowie katalytische Variante im Detail vor.
Was gibt es noch bei uns?
Was ist Technikermathe.de?
Unser Dozent Jan erklärt es dir in nur 2 Minuten!
Interaktive Übungsaufgaben
Quizfrage 1
Wusstest du, dass unter jedem Kursabschnitt eine Vielzahl von verschiedenen interaktiven Übungsaufgaben bereitsteht, mit denen du deinen aktuellen Wissensstand überprüfen kannst?
Auszüge aus unserem Kursangebot
Hat dir dieses Thema gefallen? – Ja? – Dann schaue dir auch gleich die anderen Themen zu den Kursen
FT1 (Fertigungstechnik – Grundlagen) und
WT1 (Eigenschaften von Werkstoffen) an.
Perfekte Prüfungsvorbereitung für nur 19,90 EUR/Jahr pro Onlinekurs
++ Günstiger geht’s nicht!! ++
Oder direkt >> Mitglied << werden und >> Zugriff auf alle 22 Kurse << (inkl. >> Webinare << + Unterlagen) sichern ab 8,90 EUR/Monat
++ Besser geht’s nicht!! ++
Technikermathe.de meets Social-Media
Dein Technikermathe.de-Team









