Das Gesetz von Gay-Lussac besagt, dass das Volumen und die Temperatur proportional zueinander sind, wenn der Druck konstant gehalten wird, sich also nicht verändert. Steigt das Volumen um das 10-fache, so steigt auch die Temperatur um das 10-fache.
Dieser Lerntext ist ein Auszug aus unserem Onlinekurs PH5 – Wärmelehre auf Technikermathe.de
Für ein optimales Verständnis helfen dir ein Videoclip und ein anschauliches Rechenbeispiele zu dem Thema.
Gesetz von Gay-Lussac (Druck konstant)
Das Gesetz von Gay-Lussac stellt einen Zusammenhang zwischen dem Volumen V und der Temperatur T eines idealen Gases her, wenn der Druck p konstant gehalten wird, sich also nicht verändert.
Das Ergebnis: Das Volumen ist proportional zur Temperatur bei Konstanthaltung des Drucks.
Wird das Volumen eines Gases bei konstantem Druck um das 10-fache erhöht, so erhöht sich die Temperatur ebenfalls um das 10-fache.
Betrachten wir das nachfolgende Experiment, um das Gesetz von Gay-Lussac zu erklären:
Wir sehen in der obigen animierten Grafik, ein ideales Gas (schwarze Punkte) in einem Kolben. Dieses Gas nimmt zunächst ein Volumen von 2,5 Liter ein. Wird das Gas nun erhitzt, so dehnt sich dieses aus. Das Volumen steigt dann auf 4,5l.
- Wir haben also zunächst eine Volumenzunahme von 2,5 Liter auf 4,5 Liter gegeben.
Durch die Erhitzung des Gases steigt bei Konstanthaltung des Drucks zusätzlich zum Volumen die Temperatur des Gases.
- Wir haben eine Temperaturzunahme von 250K auf 450K gegeben.
Temperatur und Volumen weisen also einen proportionalen Zusammenhang auf, wenn der Druck konstant gehalten wird.
Zustandsänderungen bei denen der Druck konstant gehalten wird, werden auch als isobare Zustandsänderungen bezeichnet.
Formel: Gesetz von Gay-Lussac
Mathematisch lässt sich das ganze wie folgt ausdrücken:
In Worten: V ist proportional zu T
Wir können die beiden Größen auch auf eine Seite bringen:
In Worten: Der Quotient aus Volumen V und Temperatur T ist konstant.
Wenn wir nun eine Zustandsänderung betrachten, so betrachten wir den Anfangszustand 1 und den Endzustand 2:
Gesetz von Gay-Lussac
Der Quotient aus Volumen und Temperatur im Zustand 1 ist gleich dem Quotienten aus Volumen und Temperatur im Zustand 2. Somit ändern sich zwar die Größen in den beiden Zuständen, nicht aber der Quotient.
Video: Gesetz von Gay-Lussac
Beispiel: Gesetz von Gay-Lussac
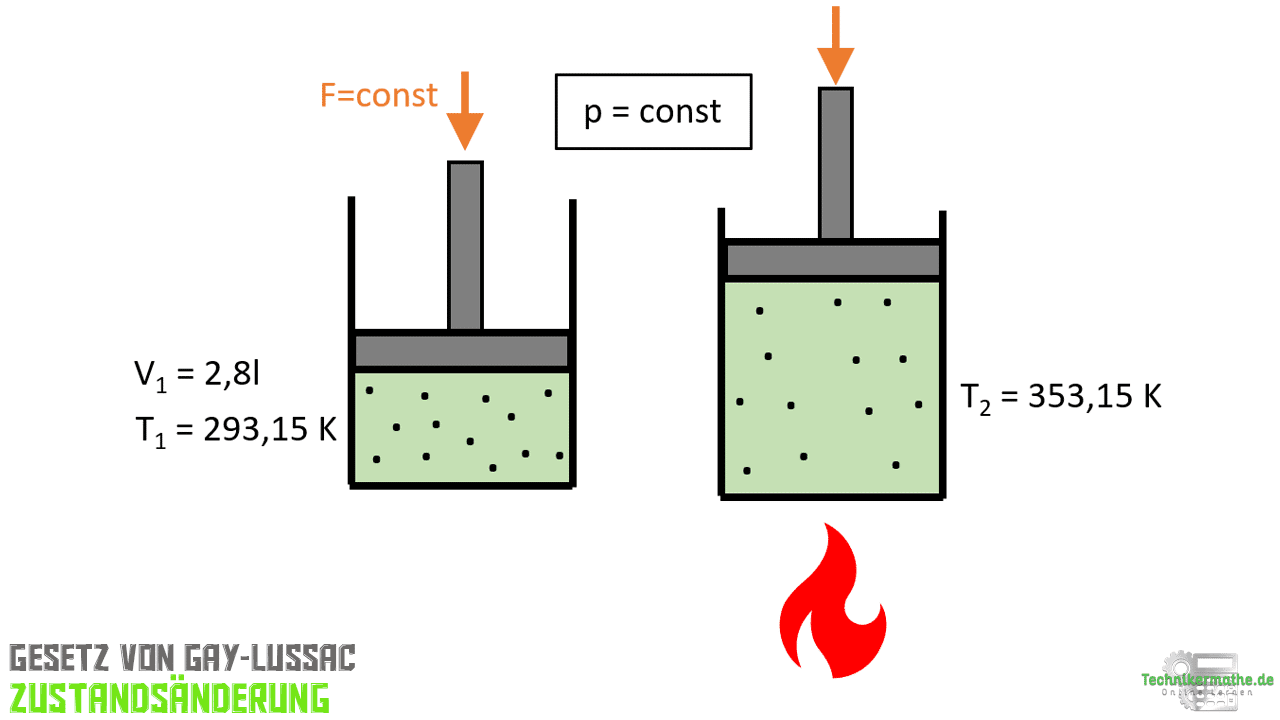
Gegeben sei ein Gas, welches sich in einem Kolben befindet. Das Gas nimmt ein Volumen von 2,8 Liter ein. Die Temperatur beträgt zu beginn 20°C. Jetzt wird das Gas auf 80°C erhitzt. Das Gas kann näherungsweise als ideales Gas angenommen werden.
Wie groß ist das Volumen nach der Expansion, wenn wir den Druck konstant halten?
Es handelt sich hierbei um das Gesetz von Gay und Lussac, da wir ein ideales Gas gegeben haben und den Druck konstant gehalten wird:
Wir haben die folgenden Größen gegeben:
Gesucht wird der das Volumen V2 nach der Expansion des Gases.
Wir können die obige Gleichung anwenden, indem wir diese nach der gesuchten Größe auflösen:
|
Einsetzen der gegebenen Werte:
Das Volumen beträgt nach der Expansion des Gases 3,37 Liter. Temperatur und Volumen steigen an. Das Verhältnis ist hier proportional.
Umstellen der Gleichung: so, dass die Temperatur und das Volumen auf einer Seite sind:
Der Quotient aus Ausgangsvolumen und Endvolumen entspricht dem Quotienten aus Ausgangstemperatur und Endtemperatur.
Wir können auch den Dreisatz anwenden, um das Volumen zu berechnen. Auf beiden Seiten erfolgen dann aber genau die gleichen Rechenschritte (siehe auch Kurs MA2: proportionale Zuordnungen):
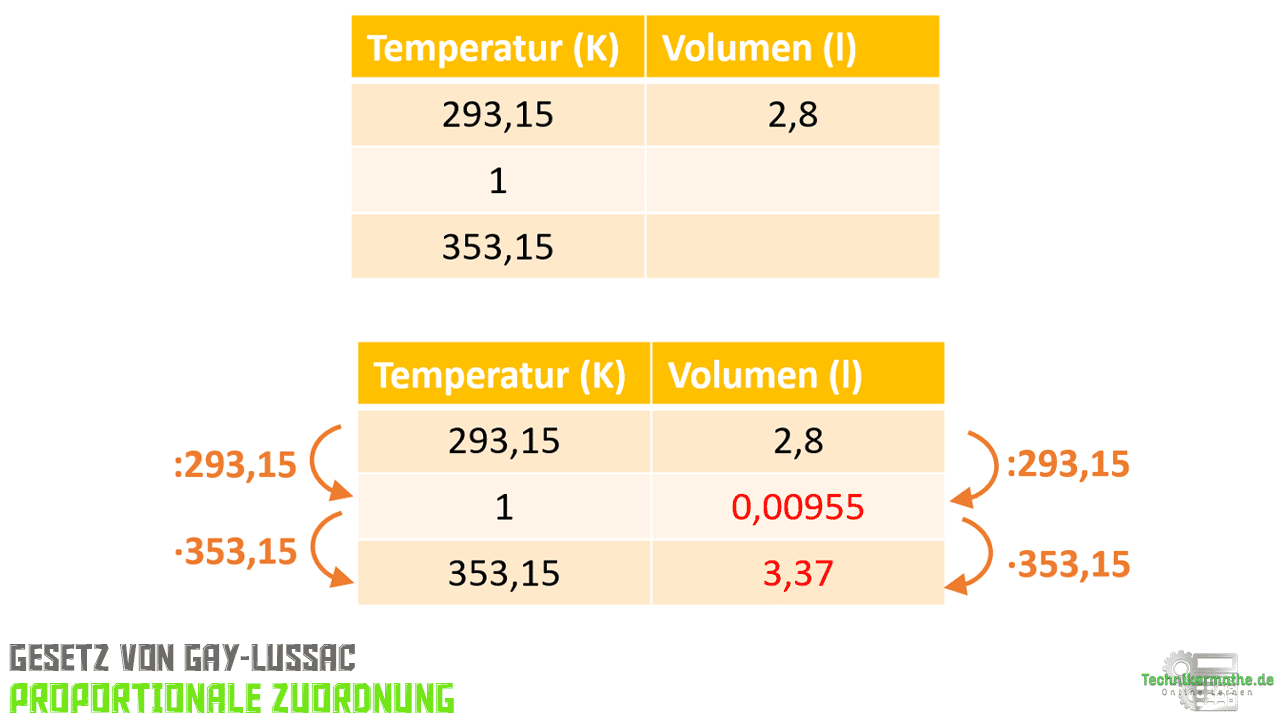
Wir tragen zunächst die beiden Größen Temperatur und Volumen in die Tabelle ein. Die Temperatur beträgt zunächst 293,15 Kelvin. Wir tragen dies in die Tabelle ein. Wir rechnen dann zunächst auf 1 Kelvin runter, indem wir durch 293,15 teilen. Die Temperatur steigt dann auf 353,15 Kelvin. Um nun von 1 Kelvin auf 353,15 Kelvin zu kommen, multiplizieren wir mit 353,15. Soviel zur linken Seite.
Jetzt betrachten wir die rechte Seite. Dort tragen wir das Volumen ein. Im Zustand 1 beträgt dieses 2,8 Liter, bei einer Temperatur von 293,15 Kelvin. Wir führen nun auf der rechten Seite genau die gleichen Rechenschritte durch. Wir dividieren zunächst durch 293,15 und erhalten dann zunächst das Volumen (0,00955 Liter), wenn die Temperatur nur noch 1 Kelvin beträgt. Danach multiplizieren wir mit 353,15 und erhalten das Volumen (3,37 Liter) bei einer Temperatur von 353,15 Kelvin.
Tausende interaktive Übungsaufgaben

Quizfrage 1
“Wusstest du, dass unter jedem Kursabschnitt eine Vielzahl von verschiedenen interaktiven Übungsaufgaben bereitsteht, mit denen du deinen aktuellen Wissensstand überprüfen kannst?”
Das erwartet dich!
Unser Dozent Jan erklärt es dir in nur 2 Minuten!
Auszüge aus unserem Kursangebot!
Hat dir dieses Thema gefallen? – Ja? – Dann schaue dir auch gleich die anderen Themen zu den Kursen
WT3 (Werkstoffprüfung) und
TM1 (Technische Mechanik – Statik) an.


Perfekte Prüfungsvorbereitung für nur 14,90 EUR/Jahr pro Onlinekurs
++ Günstiger geht’s nicht!! ++
Oder direkt >> Mitglied << werden und >> Zugriff auf alle 26 Kurse << (inkl. >> Webinare << + Unterlagen) sichern ab 8,90 EUR/Monat
++ Besser geht’s nicht!! ++
Technikermathe.de meets Social-Media
Dein Technikermathe.de-Team


![PH5 - Druck konstant: Gesetz von Gay-Lussac [Beispiel & Video] 1 Gesetz von Guy-Lussac, isobare Zustandsänderung, ideales Gas](https://technikermathe.de/wp-content/uploads/2022/06/gesetz-guy-lussac.gif)




